유기화학 26강 : 이성질체 - R, S 체계 (치환기들의 삼차원적 배열 configuration)
저번 시간에 카이랄 탄소를 배웠다.
오늘은 이 카이랄 탄소를 이용하여 R, S 체계를 알아볼 것이니 기억이 나지 않는다면
25강을 참고해주길 바란다.
R, S 체계가 필요한 이유는 다음 두 화합물을 구분하여 명명하기 위해서다.

R, S 체계에는 규칙이 크게 3가지 있는데 하나하나 차례대로 살펴보자.
규칙1. 카이랄 탄소에 직접 결합된 네 개의 원자를 찾아 원자 번호가 감소하는 순서로 나열한다.
원자 번호가 가장 큰것이 1번이 되고, 가장작은 것(주로 수소)이 4번이 된다.
Br > Cl > S > P > O > N > C > H
규칙2. 규칙1을 적용해서 순서를 결정할 수 없을 때는 (직접 결합된 원자가 서로 같은 경우) 두 번째 원자들의
원자 번호를 비교하고 필요하다면 차이점에 도달할때 까지 세번째, 네 번째를 계속 비교해 나간다.
ex)

위와 같이 직접 연결된 탄소 하나로는 파악할 수 없으므로 두번째 원소의 원자 번호 까지 비교하여
오른쪽 물질이 원자 번호가 크므로 왼쪽보다 작은 번호순서를 부여받게 됨을 알 수 있다.
규칙3. 규칙1, 2에서 네 개의 치환기의 우선순위를 결정했다 (배정된 번호가 작을 수록 우선순위가 큰것)
여기서 우선 순위가 가장 낮은 4번 치환기를 뒤로 향하도록 배열하였을 때 1 -> 2 -> 3번 치환기가
반시계 방향이면 카이랄 탄소는 S 배열을 하고 있다고 말하며, 시계 방향이면 카이랄 탄소는 R 배열을 하고 있다고 말한다.
그렇다면 다음 카이랄탄소가 R 배열인지 S 배열인지 판단해보자.
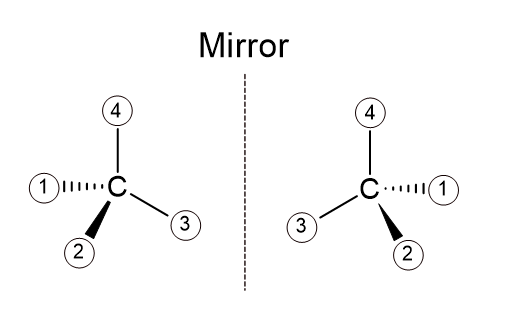
위 그림에서 양쪽 화합물은 서로 거울상 이성질체 관계에 있다.
먼저 왼쪽 화합물의 카이랄 탄소를 살펴보면
규칙1, 2를 적용한 뒤의 모습임을 알 수 있다. (1, 2, 3, 4 번으로 이미 우선순위가 결정된 것이다)
그렇다면 규칙 3의 적용만이 남았다.
규칙3에서 4번 치환기를 뒤로 향하도록 배열하라고 되어있다.
즉 다음과 같이 회전시키라는 것이다. (우리는 지금 왼쪽 카이랄 탄소를 보고 있다)

* 혹시 몰라서 설명한다.

여기 달린 원소는 입체적으로 앞쪽에 위치하고 있다는 것을 나타내며

여기 달린 원소는 상대적으로 뒷쪽에 위치하고 있다는 것을 나타낸다.

그렇다면 이제 이그림이 어떻게 회전 시켜 나온것인지 이해가 가겠는가? (4번 원소가 뒤에가도록 회전 시켰다)
이제 이 회전시킨 그림에서 R 배열인지 S 배열인지 판단해보자.
R 배열은 1 -> 2 -> 3 이 시계방향일 때고 S 배열은 반대로 반시계 방향일 때라고 규칙 3에서 설명했다.
따라서 위그림 1 -> 2 -> 3은 아래와 같이

시계 방향이므로 R형 배열임을 알 수 있다.
그런데 매번 이렇게 회전 시켜 생각하려 하니 달린 치환기가 복잡할 경우 상상하기 쉽지 않을 수 있고
시간도 오래걸릴 것이다.
따라서 앞으로 R형과 S형을 판단할 때는 다음과 같이 생각하자.
먼저 4번 우선순위 (가장 낮은 우선순위)를 가진 원자를 뒷쪽에 달려있는 원소와 '교환' 한다.
(만약 이때 4번이 이미 뒤에 달려 있다면 그냥 그 상태에서 1->2->3이 시계인지 반시계인지만 확인하면 끝난다)
'교환'의 의미는 아래와 같다.

즉 이렇게 강제로 바꿔준뒤에 시계 반시계를 판단해주면 된다.
단, 우리가 이렇게 강제로 바꿔준 것이기 때문에 최종 답을 내고자 할때는 R형 S형을 바꿔 말해주어야 한다.
그러니까 위처럼 강제로 원소 끼리 교환 시켜 준뒤 1 -> 2 -> 3 이 반시계라 S형이라고 결론을 내렸을 때는
S형이 답이 아니라 R형이 답이라는 것이다.
(이에 대해 보충 설명을 하자면 위처럼 '교환'을 해준다는 의미는 거울상 이성질체의 관계에 있는 화합물로 바꿔 준다는 뜻이므로 -> [바로 위 그림의 원소를 교환해준 두 화합물은 서로 거울상 이성질체 관계이다.] 결론을 내린 답을 바꿔 써주어야한다. )
솔직히 이렇게 길게 말로만 설명해 봤자 문제 한 문제 풀어보느니 못하다.
따라서 아래 예제를 살펴보자.
예제1) 다음 화합물들이 R 배열을 가지는지 S 배열을 가지는지 판단하여라

한번 풀어보아라.
답은 다 알려주겠지만 풀이는 1번과 2번만 진행하도록 하겠다.
풀이)
- [1]번
이 경우에는 굳이 회전이나 교환을 쓸 필요가 없다. 왜냐면 이미 4번 원소가 뒤쪽에 위치해 있기 때문이다.
따라서 1 -> 2 -> 3은 아래와 같이 반시계이므로 S형 배열을 가진다고 할 수 있다.

- [2]번
이 경우 4번 원소가 뒤쪽에 위치하고 있지 않으므로 회전이나 교환의 방법을 써야하는데
교환을 이용해 푸는것이 편하고 빠르다고 했다. 따라서 아래와 같이 4번 탄소가 뒤쪽에 오도록 '교환'을 해주면

위와 같다. 여기서 R과 S를 판단해보면

위와 같이 1 -> 2 -> 3 이 반시계 방향이므로 S형인데
그러나 교환을 한 뒤에 나온 결론이므로
교환을 하기전에는 R형임을 알 수 있다. 따라서 [2]번 답은 R형이다.
[3]번의 경우 풀이는 생략하고 답은 S형이다.
이번에는 생각보다 말이 길어졌다.
사실 풀어야할 문제가 몇 가지 더 있는데 이 문제들은
다음 강의로 넘기도록 하겠다.
'밤샘화학 > 유기화학' 카테고리의 다른 글
| 유기화학 27강 : 이성질체 - RS 체계 익숙해지기 (1) | 2020.08.26 |
|---|---|
| 유기화학 25강 : 이성질체 - 카이랄 탄소 (0) | 2020.08.26 |
| 유기화학 24강 : 이성질체 - 불포화도 응용 (0) | 2020.08.26 |
| 유기화학 23강 : 이성질체 - 불포화도 계산법 (0) | 2020.08.26 |
| 유기화학 22강 : 이성질체 - 구조 이성질체 (알케인) (0) | 2020.08.26 |
댓글
이 글 공유하기
다른 글
-
유기화학 27강 : 이성질체 - RS 체계 익숙해지기
유기화학 27강 : 이성질체 - RS 체계 익숙해지기
2020.08.26 -
유기화학 25강 : 이성질체 - 카이랄 탄소
유기화학 25강 : 이성질체 - 카이랄 탄소
2020.08.26 -
유기화학 24강 : 이성질체 - 불포화도 응용
유기화학 24강 : 이성질체 - 불포화도 응용
2020.08.26 -
유기화학 23강 : 이성질체 - 불포화도 계산법
유기화학 23강 : 이성질체 - 불포화도 계산법
2020.08.26