유기화학 25강 : 이성질체 - 카이랄 탄소
지지...지난 강의 에서 카이랄 탄소를 잠시 언급했었다.
다음 시간에 배울 R, S 체계를 알기 위해서는
카이랄 탄소의 개념이 매우매우 중요하다.
따라서 다시한번 언급하는 것이다.
본격적으로 카이랄 탄소에대해 공부하기 앞서 큰 줄기를 다시한번 살펴보자.
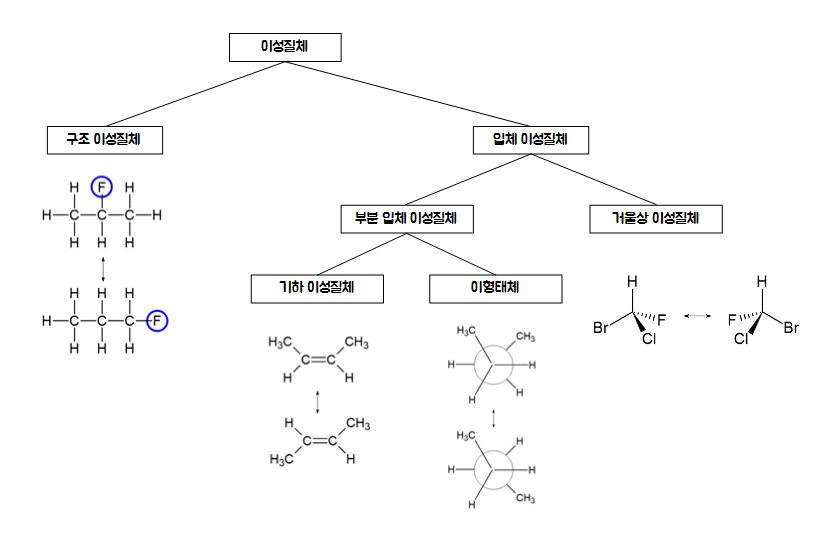
여기서 오늘 주목해야할 부분은 거울상 이성질체 이다.
카이랄 탄소의 유무에 따라 거울상 이성질체의 유무가 결정되기 때문이다.
위 그림속 거울상 이성질체의 예시에서 중심부에 있는 탄소가 바로 카이랄 탄소이다.
그렇다면 카이랄탄소는 무엇일까?
먼저 '카이랄 하다'라는 것의 뜻을 알 필요가 있다.
'카이랄 하다' = '광학 활성을 띤다' => 거울상 이성질체를 가진다
라는 뜻을 내포하고 있는데 이것만 보면 무슨말인지 잘 모른다 예시를 한번 살펴보자.

익숙하지 않은가? 그렇다 위에 있는 그림을 그대로 가져온것 뿐이다.
양쪽에 있는 화합물이 서로 기하이성질체 관계에 있으며 중심부에 있는 탄소가
카이랄 탄소인데, 위 그림에서 카이랄 탄소의 대표적 특징을 알 수 있다.
"카이랄 탄소는 탄소 팔에 달린 화합물들이 모두 달라야 한다." !!
위 예시에서는 H, Br, Cl, F 로 탄소에 모두 다른것들이 달려 있음을 알 수 있다.
아래 화합물에서 카이랄 탄소를 찾아보자.

다시 한번 말하지만 카이랄 탄소는 탄소 팔에 달린 물질들이 모두 달라야한다.
힌트를 하나 더 주자면 1번은 1개, 2번도 1개, 3번은 2개의 카이랄 탄소가 존재한다
(지금보니 3번은 답을 줘버렸다)
답은 아래와 같다
.
.
.
.
.
.

2번 답에는 양쪽에 탄소가 2개 달려있으니 카이랄 탄소가 아니지 않나요? 라는 의문점이 들 수 있는데
카이랄 탄소를 판별할때는 원자 1개만 보면 안된다. 달려 있는 전체를 봐야한다 즉 탄소끼리만 비교해야하면 안되고
아래 2개를 비교하여 다른지 같은지 판별해야한다.


전체를 비교해야 하므로 당연히 두 물질은 다르다! 따라서 카이랄 탄소이다.
마지막으로 카이랄 탄소를 찾는 꿀팁 하나를 주자면
아래와 같이 H를 생략하는 구조식의 그림에서는
탄소에 달려있는 선의 개수가 아래와 같이 2개 이하라면 무조건 카이랄 탄소가 될 수 없다.

왜냐하면 생략된 나머지 2개 이상의 선에는 수소가 달려있을 것이므로
적어도 2개의 중복되는 수소가 존재하여 카이랄 탄소가 될 수 없다!
다음 시간에는 카이랄 탄소를 이용하여 R, S 체계를 공부하자.
'밤샘화학 > 유기화학' 카테고리의 다른 글
| 유기화학 27강 : 이성질체 - RS 체계 익숙해지기 (1) | 2020.08.26 |
|---|---|
| 유기화학 26강 : 이성질체 - R, S 체계 (치환기들의 삼차원적 배열 configuration) (4) | 2020.08.26 |
| 유기화학 24강 : 이성질체 - 불포화도 응용 (0) | 2020.08.26 |
| 유기화학 23강 : 이성질체 - 불포화도 계산법 (0) | 2020.08.26 |
| 유기화학 22강 : 이성질체 - 구조 이성질체 (알케인) (0) | 2020.08.26 |
댓글
이 글 공유하기
다른 글
-
유기화학 27강 : 이성질체 - RS 체계 익숙해지기
유기화학 27강 : 이성질체 - RS 체계 익숙해지기
2020.08.26 -
유기화학 26강 : 이성질체 - R, S 체계 (치환기들의 삼차원적 배열 configuration)
유기화학 26강 : 이성질체 - R, S 체계 (치환기들의 삼차원적 배열 configuration)
2020.08.26 -
유기화학 24강 : 이성질체 - 불포화도 응용
유기화학 24강 : 이성질체 - 불포화도 응용
2020.08.26 -
유기화학 23강 : 이성질체 - 불포화도 계산법
유기화학 23강 : 이성질체 - 불포화도 계산법
2020.08.26